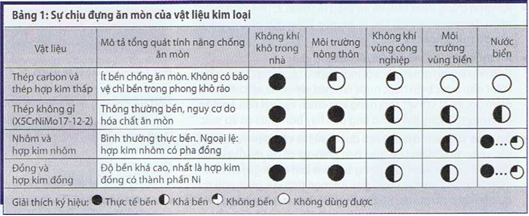
Các thiết bị có thể ăn được trong khi kết hợp với nhau, trong kho Người ta có thể có thể ăn được.
Tập hợp tài liệu tổng hợp
Ăn mặc, ăn mặc, vui vẻ, thoải mái, vui vẻ, thoải mái. Đột phá chỉ là một phần của nhau.
Thông thường, không có gì khó khăn, làm như vậy là thú vị, làm như vậy. Như một người khác, chúng ta có thể ăn thịt người.
Thiết bị của bạn
Sức mạnh và máy tính
không có gì
(Hình 1):
Trong phần ăn của bạn và phần của anh ấy.
Tránh có khe hở bằng cách thực hiện mối hàn đúng cách thay vì kết nối bulông. Sử dụng tiết diện kín thí dụ ống tròn.
Cắn tạo bề mặt láng nhiều nhưcóthể,thídụ như qua mài hay đánh bóng.
Loại bỏ đỉnh ứng suất trong cấu kiện bằng cách tránh sử dụng khía sắc cạnh hoặc cách chuyển tiếp đột ngột giữa tiết diện.
Giảm tính ăn mòn của chất bao quanh
Trong nhiều trường hợp, không phải toàn thể mà chỉ từng thành phần của chất bao quanh có tác động ăn mòn, thí dụ như độ ẩm của không khí hay ion axit trong chất bôi trơn làm nguội. Bằng cách tách rời chất ăn mòn ra khỏi môi trường bao quanh người ta có thể giảm tác động ăn mòn một cách đáng kể hoặc loại trừ hẳn. Cách này phẩn nào có thể thực hiện bằng cách đơn giản.
Thí dụ: Chất bôi trơn làm nguội và chất bôi trơn được pha thêm vào chất kìm hãm (chất ức chế) ăn mòn. Chất này kết hợp với thành phần ăn mòn đã được đưa vào, thí dụ như muối hay ion axit, và làm cho chúng vô hại.
Bảo vệ chống ăn mòn trong lúc và sau khi gia công cắt gọt
Trong lúc gia công cắt gọt, sự ăn mòn bị cản trở bằng chất kìm hãm được pha vào chất làm nguội và bôi trơn. Chất kìm hãm là chất gây tác dụng thụ động có dạng dầu hay chất dạng như muối. Chúng kết thành trên vật liệu một lớp mỏng bảo vệ chỉ dày độ vài lớp phân tử không nhìn thẫy bằng mất thường. Ngay sau khi gia công xong phải tẩy nước với dung dịch cắt gọt (chất làm nguội và bôi trơn) dính ở bề mặt chi tiết để bảo vệ cho đến bước gia công kế tiếp. Để thực hiện điều này người ta nhúng chi tiết vào dầu chống ăn mòn cộng thêm với phụ chất kìm hãm và chất choán chỗ của nước. Chi tiết cẩn đưa vào kho sau khi sản xuất, được làm sạch và làm khô rồi nhúng vào sơn trong để phủ một lớp mỏng (Hình 1) hoặc được bọc bằng một lớp giấy đặc biệt có thấm
dầu để bảo vệ chống ăn mòn.
Hình 1: Dụng cụ và cấu kiện được bảo vệ
Phương pháp bảo vệ chống ăn mòn bằng cách tô một lớp phim mỏng hay một lớp bảo vệ lên trên cấu kiện được ứng dụng ở thép carbon, thép hợp kim thấp hay vật liệu gang sất. Tùy theo thời gian bảo vệ muốn đạt tới, tính chất của bề mặt vật liệu được yêu cẩu và các chất ăn mòn mà người ta sửdụng những cách tráng (phủ lớp) khác nhau.
Ăn mòn nhiệt độ cao
Trong ăn mòn nhiệt độ cao vật liệu phản ứng trực tiếp với chất tác động, không có sự cùng tác dụng của độ ẩm.
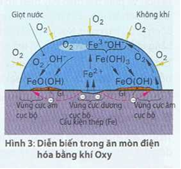
Thí dụ: Việc tạo oxit sắt ở trên một chi tiết rèn được nung trong biến dạng nóng (Hình 3).
Trong quá trình này sắt (Fe) phản ứng với oxy (02) thành oxít sắt (Fe205) theo phương trình phản ứng 4Fe+302 —> 2 Fe205. ở nhiệt độ bình thường của môi trường vật liệu kim loại chi phản ứng với khí khô trong trường hợp ngoại lệ, thí dụ như khí clor khô có tính ăn mòn. Kim loại chĩ phản ứng với không khí khô ở nhiệt độ cao. Vì thế loại ăn mòn này được gọi là ăn mòn nhiệt độ cao hay gọi đơn giản là bị gỉ sét khi nóng.
Ăn mòn nhiệt độ cao xuất hiện vào lúc rèn, vào lúc nung và vào lúc tôi các chi tiết.
Các loại ăn mòn và đặc điểm bể ngoài của nó
Tùy theo vật liệu và tác nhân ăn mòn (chất tác dụng ăn mòn), các
loại ăn mòn xuất hiện với những hình thức bề ngoài điển hình
như sau:
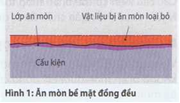
Ăn mòn bề mặt đổng đều (Hình 1).
Ở đây bể mặt bị ăn mòn
tấn công hầu nhưđều đặn và chậm. Loại ăn mòn này xuất hiện nơi những cấu kiện bằng thép carbon không có lớp phủ để ngoài trời hay tại những chi tiết rèn bị ăn mòn ở nhiệt độ cao.
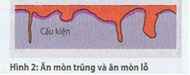
Ăn mòn trũng (lõm sâu) và ăn mòn lỗ (Hình 2) phẩn lớn được nhận dạng qua việc vật liệu bị ăn mòn dạng mặt phẳng thêm vào đó trũng hoặc lỗ.
Ăn thủng lỗ (Ăn mòn điềm, ăn mòn lỗ chỗ)
Nơi thép không gỉ tiếp xúc với môi trường tác dụng có chứa ion chlor như nước biển hoặc nước có chứa chlor,cũng có ăn mòn điểm độc nhất với vết khía dạng kim chích vào vật liệu. Loại ăn mòn này rất nguy hiểm cho ống dẫn hay bổn chứa có áp suất.
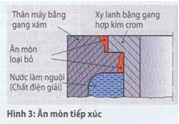
Ăn mòn tiếp xúc (Hình 3) có được khi hai cấu kiện từ các vật liệu khác nhau nằm tiếp giáp bên nhau và có độ ẩm (làm chất điện giải).
Chất kém quý trong hai kim loại của nguyên tố ăn mòn sẽ bị phá hủy do phân giải. Ăn mòn tiếp xúc phát sinh thí dụ như tại ổ trượt, nếu những ống lót (bạc lót) làm bằng một vật liệu khác với khung bợ trục hoặc là lắp ghép bằng bulông, khi bulông và các phẩn kết nối bằng những vật liệu khác nhau.
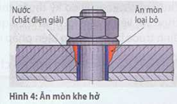
Ăn mòn khe hở (Hình 4) xuất hiện khi hàm lượng oxy khác biệt trong chất điện giải vì sự thâm nhập không khí vào khe hở bị cản trở.
Đó là trường hợp trong khe lắp ghép giữa hai cấu kiện (gỉ lắp ghép) hoặc là ở trong khe hở giữa lỗ thông và vít hoặc là các tấm được hàn nằm chổng lên nhau.
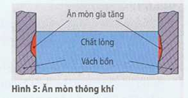
Ăn mòn thông khí (Hình 5) xuất hiện nơi những thùng chứa được đổ nước vào một phẩn.
Sự tấn công ăn mòn xảy ra trước ở vị trí dưới mặt nước một tí. Nguyên nhân là sự khác biệt về hàm lượng oxy ở bể mặt và lớp nước sâu hơn.
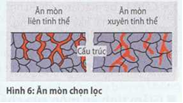
Ăn mòn chọn lọc (Hình 6).
Trong nhóm này việc tấn công ăn mòn được ưu tiên (có lựa chọn) chạy dọc theo một vùng nhất định của cấu trúc.
Tùy theo vùng cấu trúc bị phá hủy người ta phân chia thành:
Ăn mòn liên tinh thể, khi sự phá hủy chạy dọc theo đường biên của các hạt tinh thể,
Ăn mòn xuyên tinh thể, khi ăn mòn đi xuyên qua các tinh thể. Vì ăn mòn chọn lọc xuất hiện trong phạm vi kích cỡ của tinh thể, nếu nhìn bằng mắt thường sẽ không nhận thấy được cho nên đặc biệt nguy hiểm.
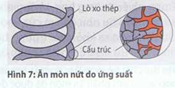
Ăn mòn nứt do ứng suất và ăn mòn nứt do rung (Hình 7) xảy ra vì tương tác của tấn công dạng điện hóa (như khí quyển khu kỹ nghệ) và tải kéo cao của một cấu kiện.
Tùy theo môi trường tác dụng và loại tải, ăn mòn tiến theo hướng liên tinh thể hoặc xuyên tinh thể..
Ăn mòn và bảo vệ chống ăn mòn
Người ta hiểu nghĩa ăn mòn là sự tấn công và phá hủy vật liệu kim loại bằng phản ứng hóa hay điện hóa với chất tác dụng (kích thích tố) của môi trường xung quanh.
Chất ăn mòn (chất tác dụng) là những chất xung quanh cấu kiện, tác động lên vật liệu và là nguyên nhân gây ra ăn mòn thí dụ như không khí trong phòng, khí quyển ngoài trời có hoặc không có ô nhiễm kỹ nghệ, khí quyển vùng biển, nước ngọt và nước mặn, mặt đất hay hóa chất. Những tổn hại do sự ăn mòn nơi xe cộ, thiết bị và cấu kiện thép rất lớn (Hình 1).
Có thể hạn chế một phẩn bằng cách ứng dụng những phương pháp bảo vệ
phù hợp.
Nguyên nhân ăn mòn
Quá trình ăn mòn diễn biến tùy theo hoàn cảnh, theo nhiều cách tác dụng khác biệt. Do đó người ta phân chia ra thành ăn mòn điện hóa và ăn mòn ở nhiệt độ cao.
Hư hòng ăn mòn thường xuyên nhất trong máy móc dựa trên cơ bản ăn mòn điện hóa.
Ăn mòn điện hóa
Trong loại ăn mòn điện hóa, trên mặt kim loại quá trình ăn mòn xảy ra dưới lớp màng nước có khả năng dẫn điện, chất điện giải.
Một chất điện giải có thể là một lớp độ ẩm rất mỏng hay nước còn lại trong khe hở mà cũng có thể là mổ hôi tay dính lên chi tiết.
Ăn mòn điện hóa bằng dưỡng khí (khí oxy) trên mặt thép ẩm
Bể mặt của cấu kiện kim loại bị lớp màng ẩm phủ lên trong phòng có độ ẩm hay thời tiết ẩm ướt ngoài trời, cấu kiện có mặt láng bằng thép carbon hay thép hợp kim thấp sẽ bị đốm gỉ vẩy đầy sau một vài ngày (Hình 2).
Những biến chuyển, cơ bản xảy ra trong loại ăn mòn này, dựa trên tác dụng vào vật liệu sắt của Oxy trong không khí kết hợp với nước.
Xét phạm vi của vật liệu dưới một giọt nước, người ta có thể giải thích được những diễn biến này (Hình 3): ở trung tâm giọt nước, sắt hòa tan thành ion Fe2+.
Vùng vật liệu này tác động như một khoảng dương cực cục bộ (vùng cực dương).
Trong phạm vi biên của giọt nước những ion OH-, tạo thành do phản ứng giữa Oxy của không khí trong nước, với ion sắt Fe2+ lúc ban đắu thành hyđrôxít sắt Fe(OH)3 và từ đó trở thành lớp gi FeO(OH). Chất này tách rời thành một dạng vòng ở biên giọt nước.
Sự cấu tạo đốm gỉ lúc ban đẩu có thể quan sát trên mặt thép (Hình
2). Trong diễn biến tiếp tục của quá trình ăn mòn, toàn thể diện tích của mặt thép sẽ bị gặm mòn từ những vị trí này.
Ăn mòn điện hóa nơi nguyên tô ăn mòn
Loại ăn mòn này dựa trên tiến triển tương tự như của một nguyên tố điện giải. Một pin điện gổm có hai điện cực bằng kim loại khác nhau cắm vào một chất lỏng dẫn điện, chất điện giải (Hình 4).
Với sắp xếp này kim loại kém quý hơn bị hòa tan; nó bị ăn mòn.
Nơi nguyên tố điện giải kẽm/đồng, điện cực kẽm (cực dương) sẽ hòa tan dưới dạng ion Zn2+, trong khi đó ở điện cực đổng (cực âm) nước phân hóa để phát sinh ra khí hydro (khinh khi’). Giữa đôi điện cực có một điện áp thấp, tùy thuộc vào vật liệu của điện cực.
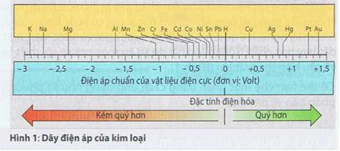
Qua đo đạc, điện áp của từng vật liệu điện cực được xác định, được gọi là điện áp chuẩn. Chúng được ghi vào dãy điện áp của kim loại (Hình 1).
Phía trái điện áp bằng không của khí hydro tụ họp những kim loại thường, phía phải tụ họp kim loại quý.
Trong một nguyên tố điện giải, kim loại nằm xa hơn bên trái sẽ bị hòa Vật liệu điện cực tan, thí dụ như chất kẽm ở nguyên tố Zn/Cu (Hình 4, trang 301). Độ lớn của điện áp trong nguyên tố điện giải có thể tính từ sự khác biệt của điện áp chuẩn.
Thí dụ: nguyên tố điện giải Zn/Cu.Điện áp chuẩn của đồng là +0,34 V, của kẽm là -0,76V. Nhờ đó nguyên tố điện giải có một điện áp +0,34 V- (-0,76 V) = 0,34V + 0,76 v= 1,1 V
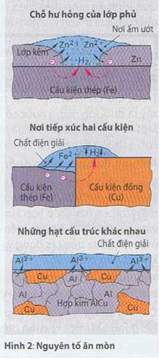
Điểu kiện để thành nguyên tố điện giải được hiện diện trên nhiểu vị trí của thiết bị và cấu kiện. Những phạm vi này được gọi là nguyên tố ăn mòn. Để có nguyên tố này cần phải có hai kim loại khác nhau và một ít chất lỏng (chất điện giải).
Tiêu biểu cho nguyên tố ăn mòn là chỗ hư hỏng của lớp mạ kim loại trên mặt của cấu kiện bằng thép hoặc nơi tiếp xúc của hai bộ phận bằng vật liệu khác nhau cũng như thành phần cấu trúc khác nhau của hợp kim (Hình 2).
Mỗi loại kim loại thường ở những chỗ này sẽ bị hư hỏng do sự hòa tan vào chất điện giải.
Sự thụ động. Trong thực tế một số kim loại có tính chất không như sự chờ đợi theo dãy điện áp của kim loại.
Thí nghiệm: Lớp phủ crom trên nền tảng. Khi chúng ta ăn thịt, ăn thịt, ăn thịt, ăn thịt, ăn thịt, ăn thịt, ngon miệng, ngon miệng. Crom crom. Nguyên làm là một thứ gì đó, một thứ gì đó tuyệt vời. Vì thê ‘phạm phần ăn mòn.
Tác dụng của bạn, phần cứng và hình chữ nhật, hình chữ nhật và hình chữ nhật