MẠ NIKEN HÓA HỌC
– Mạ niken hóa học dùng nhiều loại chất khứ, căn cứ vào sử dụng chất khử khác nhau mà phân ra các loại mạ niken hóa học. Ví dụ: mạ niken hóa học chất khử là NaH2P04, mạ niken hóa học chất khử là NaBH4, mạ niken hóa học chất khử là (CHO3)2NHBH3 …
– Mạ niken hóa học là công nghệ đuợc sứ dụng nhiều nhất. Lớp mạ niken hóa học có tính ổn định cao, độ xốp nhỏ… Vì vậy, mạ niken hóa học dùng đê chống gỉ trong công nghiệp. Ví dụ: thiết bị hóa học, dầu mỏ, tên lửa, động cơ phun khí …Ngoài ra, mạ niken hóa học có độ cứng cao, chịu mài mòn tốt, có thể mạ được những chi tiết như trục khuỷu, bơm, máy nén không khí… để kéo dài thời gian sử dụng.
I. Mạ niken hóa học NaH2P02
Mạ niken hóa học NaH2PO2 có hai loại: mạ tính kiềm và tính axit.
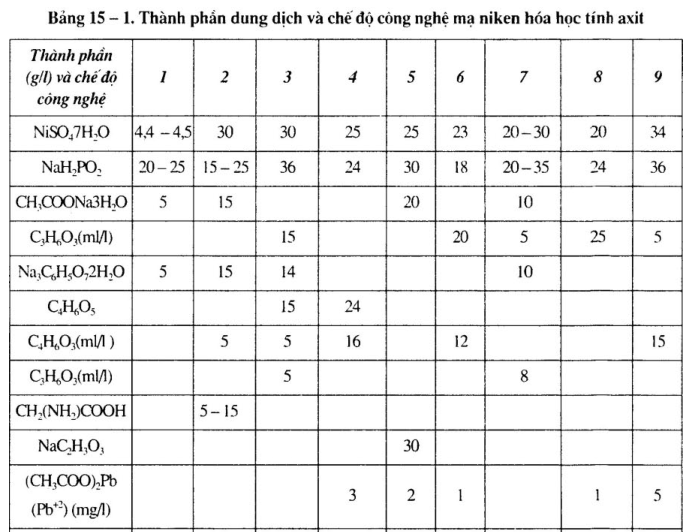
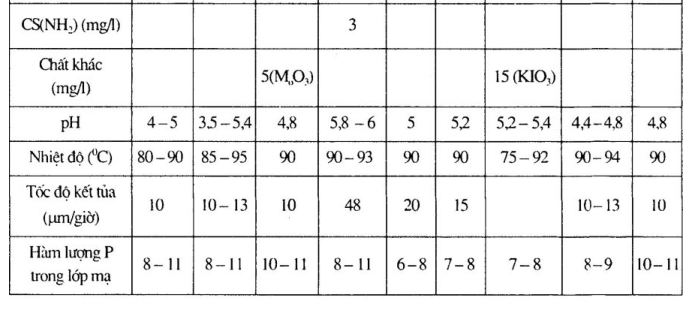
1.Thành phần dung dịch và chế độ công nghệ mạ niken hóa học tính axit, chất khử là NaH2PO2
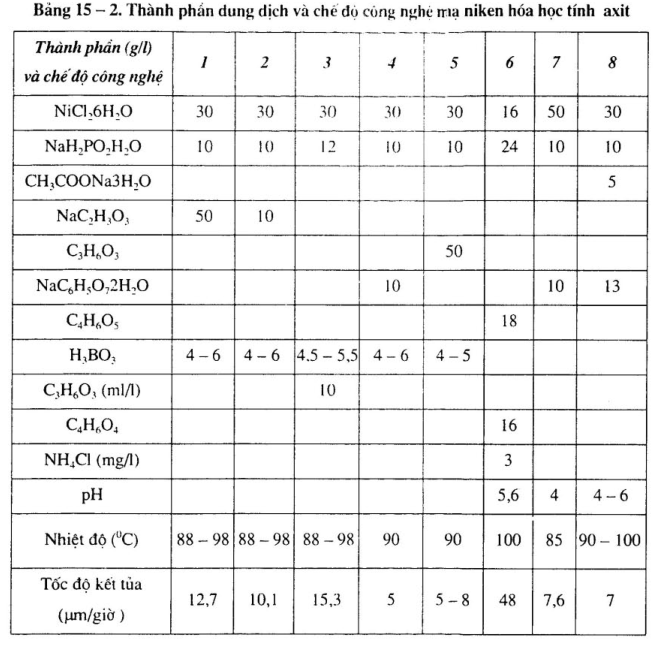
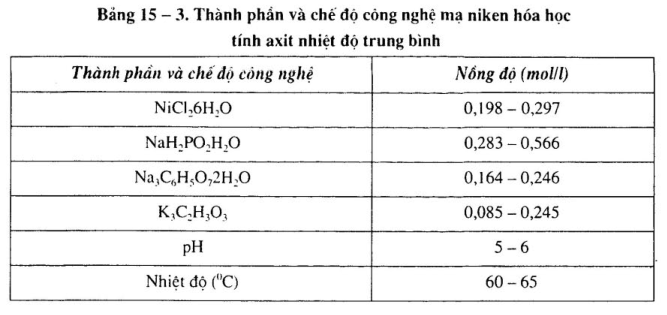
a. Thành phần dung dịch và chế độ công nghệ mạ niken hóa học khác nhau.
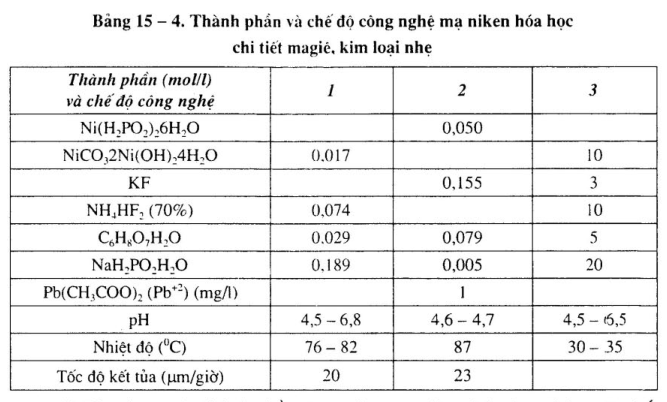
Xem bảng 15 – 1 đến bảng 15 – 4.
b. Tác dụng các thành phần dung dịch mạ niken hóa học tính axit, chất khử là NaH2P02
– Muối niken: Muối niken là thành phần chủ yếu dung dịch mạ niken hóa học, là chất cung cấp ion Ni+2 trong dung dịch.
– Chất khử: NaH2F02 là chất khử trong dung dịch mạ niken hóa học, làm cho ion Ni+2 bị khử thành lớp mạ.
– Chất tạo phức: Chất tạo phức tác dụng với ion Ni+2 tạo thành phức ổn định, chống sự tạo thành kết tủa Ni(OH)2 và NiHPO3
– Chất đệm pH: Tính ổn định dung dịch, tốc độ kết tủa, chất lượng lớp mạ chịu ánh hưởng rất lớn bời pH của dung dịch. Cho chất đệm pH làm pH của dung dịch ổn định.
– Chất ổn định: Trong dung dịch mạ niken hóa học có một số hạt keo và hạt chất rắn rất nhỏ, chúng là trung tâm xúc tác, làm tăng sự phân hủy của dung dịch. Chất ổn định có tác dụng chống hoặc làm chậm sự phân hủy của dung dịch, làm cho dung dịch ổn định.
– Chất làm bóng: Thông thường lớp mạ niken là lớp mạ bán bóng, dể được lớp mạ bóng thường cho thêm chất làm bóng.
– Chất tăng tốc: Khi cho chất tăng tốc và chất ổn định, làm giảm tốc độ kết tủa niken, cho chất tăng tốc, nâng cao tốc độ kết tủa.
c. Ảnh hường của điều kiện công nghệ mạ niken hóa học tính axit, chất khử là NaH2P02
– Ảnh hướng của pH: Trong quá trình mạ, kết tủa không ngừng tiến hành, làm cho pH không ngừng giảm đi, đổng thời tốc độ kết tủa giảm xuống. Trong dung dịch tính axit. nếu pH < 3, ion Ni+2 không bị khử tách ra. Hàm lượng p trong lớp mạ cũng thay đổi theo sự thay đổi của pH.
– Ảnh hưởng của nhiệt độ: Trong dung dịch mạ niken hóa học, nhiệt độ phải cao hơn 50°c mới hình thành lớp mạ. Nhiệt độ thao tác khí mạ ni ken hóa học tính axit, chất khử là NaH2P02 thường là 85 – 95°c. Nhiệt độ quá cao. dung dịch không ổn định, dễ bị phân hủy, nhiệt độ thấp, phản ứng không tiến hành. Hiệu suất kết tủa lớp mạ tăng lên theo nhiệt độ, hàm lượng p trong lớp mạ giám đi khi nhiệt độ tăng lên.
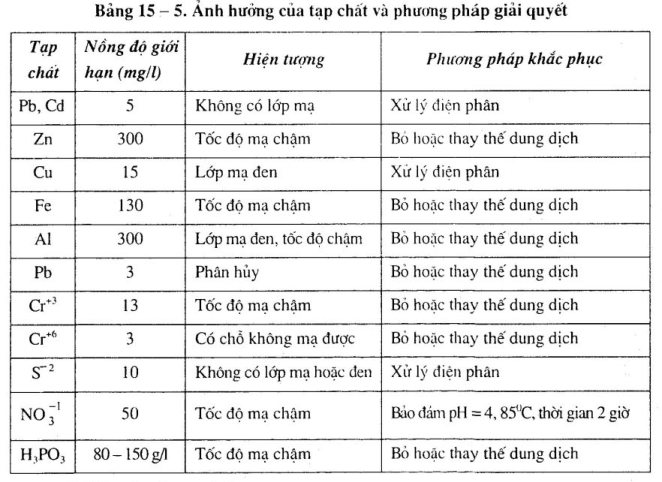
– Ảnh hưởng của tạp chất: Dung môi tẩy dấu. dầu mỡ axit và tạp chất khác …làm cho lóp mạ có vãn hoặc vệt, độ bám chắc khôpng tốt. Những tạp chất ion Pb+2, Cr+2 Cu+2, Zn+2, Fe+2…vượt quá phạm vi quy định, ảnh hưởng tới chất lượng lớp mạ. Ảnh hưởng của những tạp chất ion này và phương pháp giải quvết xem bảng 15-5.
d. Bảo vệ công nghệ
– Thời gian kết tủa càng dài, nồng độ muối niken và NaH2P02 giảm thấp, tính ổn định dung dịch kém, cho nên cần thường xuyên bổ sung. Khi nhiệt độ dung dịch giảm thấp, cho lần lượt hai chất vào, khuấy đều.
– Khống chế hàm lượng tạp chất Pb, Cd. Zn, Cu, AI, Cr+2 Cr+2, S+2, NO 3-1 H3PO3.
– Để tránh quá nhiệt cục bộ, dẫn đến phân hủy dung dịch, tốt nhất là gia nhiệt gián tiếp qua thùng nước nóng. Có thể gia nhiệt trực tiếp bằng hơi nước hoặc gia nhiệt diện, nhưng cần khuấy bằng không khí nén.
– Lượng chi tiết cho vào với diện tích 0.5 – 1,5 dm2/l là thích hợp.
– Khi mạ niken hóa học nhiệt độ cao. chi tiết cần phải gia nhiệt, sau đó cho vào bể mạ.
– Cần định kỳ lọc dung dịch liên tục để loại bỏ tạp chất rắn. Khi thành bể có lóp mạ niken, cần phải tẩy trong HNO3. Sau khi sử dụng xong dung dịch, cần lọc. giảm nhiệt để bảo tồn.
e. Pha chế dung dịch
– Tính toán lượng dùng các hóa chất, hòa tan riêng biệt từng phần trong nước cất hoặc nước trao đổi ion;
– Vừa khuấy, vừa cho dung dịch muối niken đã hòa tan vào trong dung dịch phức (như Na3C6H5O7). ta được dung dịch 1;
– Vừa khuấy, vừa cho chất khử (như NaH2PO2) vào trong dưng dịch 1, ta được dung dịch 2;
– Những dung dịch còn lại, vừa khuấy vừa cho từng loại vào trong dung dịch 2;
– Làm loãng bằng nước cất hoặc nước khử ion đến thể tích quy định;
– Điều chỉnh pH bằng dung dịch loãng H2S04, NH4OH, hoặc NaOH;
– Lọc dung dịch;
– Phân tích, điều chỉnh dung dịch.
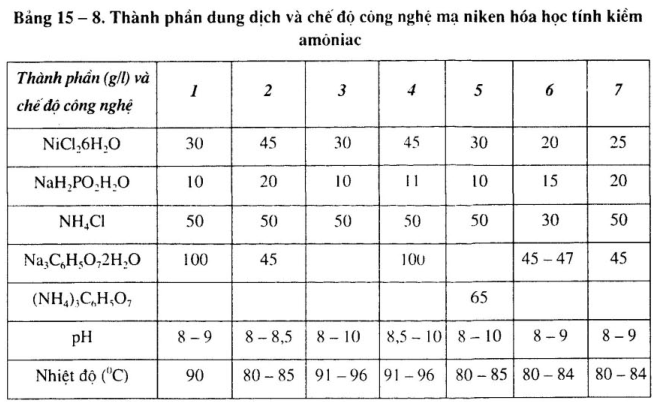
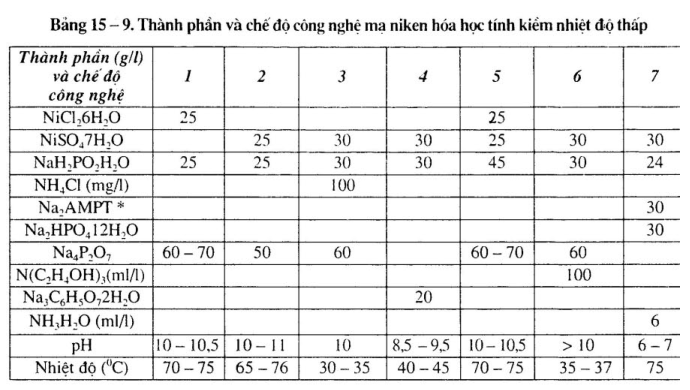
2. Thành phần dung dịch và chế độ công nghệ dung dịch mạ niken hóa học tính kiềm chất khử NaH2P02
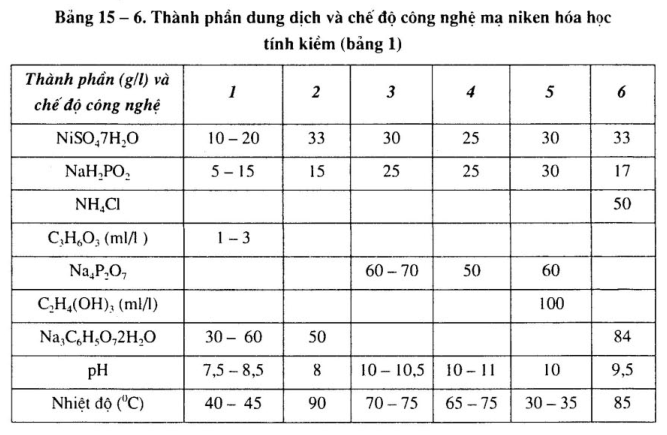
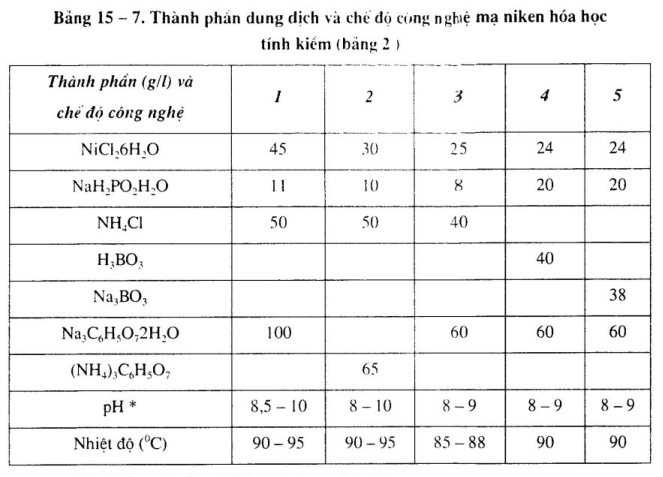
Thành phần dung dịch và chế độ công nghệ dung dịch mạ niken khác nhau, xem bảng 15-6 đến bảng 15-9.
– Pha chế 1 – 3: dùng NH4OH điều chỉnh pH.
– Pha chế 4-5: dùng dung dịch NaOH để điều chỉnh
Pha chế theo tỷ lệ: cứ 100 g AMPT 50% cần 16 g NaOH. Vừa khuấy, vừa cho dần dần AMPT vào dung dịch NaOH 30%, khuấy 30 phút. Sau khi bay hơi phần lớn lượng nước, để ớ thùng nước 70″c, thời gian 6-8 giờ. Sau khi lọc được tinh thể, sấy khô 65°c, được chất rắn màu trắng Na2AMPT. Dùng NaOH để điều chỉnh pH.
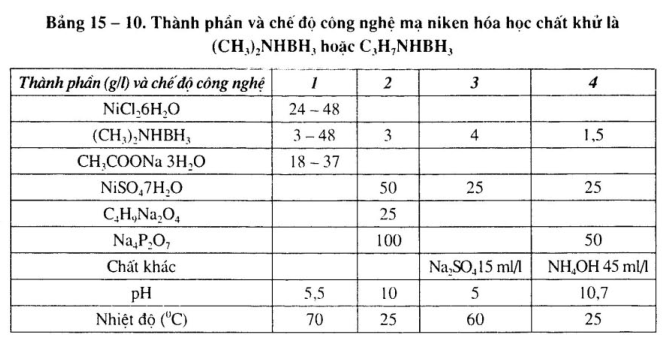
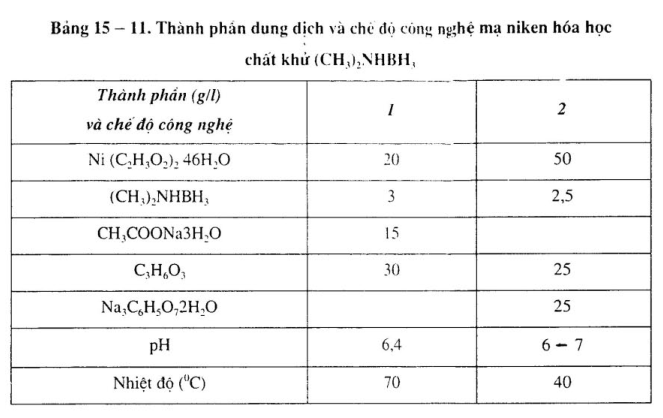
2. Mạ rtiken hóa học chất khử là (CH3)2 NHBH3 hoặc C3H7NHBH3
Mạ niken hóa học chất khử là (CH3)2NHBH3 hoặc C3H7NHBH3, thao tác trong phạm vi pH rộng, sử dụng nhiệt độ thấp, năng lực tái sinh dung dịch mạnh, chu kỳ sử dụng dài, tính ổn định dung dịch cao. Những kim loại như đồng, bạc, thép không gỉ không có năng lực xúc tác trong dung dịch (CH3)2NHBH3. Thành phần dung dịch và chế độ công nghệ xem bảng 15 – 10. 15 — 11.
3. Mạ niken hóa học chất khử là N2H4H2SO4 hoặc N2H4 H20
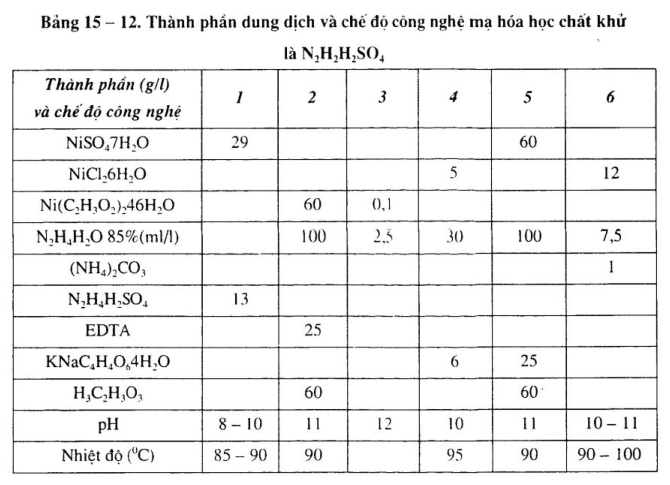
Thành phần và chế độ công nghệ xem bảng 15 – 12.
4. Mạ niken hóa học chất khử là NaBH4
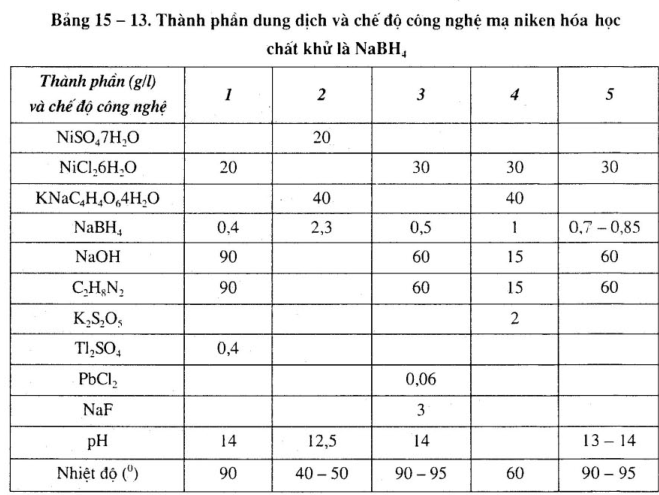
Thành phần dung dịch và chế độ công nghệ mạ niken hóa học chất khử là NaBH4, xem bảng 15 – 13.
5. Bảo vệ dung dịch mạ nỉken hóa học
Mạ niken hóa học dể bị phân hủy tự nhiên, để tránh dung dịch phân hủy, bảo đảm thời gian sử dụng, cần chú ý mấy vấn đề sau:
– Không cho NaH2P02 là chất rắn, dung dịch NaH2P02 có hàm lượng cao, kiềm là chất rắn hoặc dung dịch hàm lượng cao trực tiếp bổ sung vào dung dịch mạ, khi cho cần phải giảm nhiệt, vừa cho, vừa khuấy đều.
– Cần tránh quá nhiệt cục bộ, khi gia nhiệt tốt nhất gia nhiệt gián tiếp.
– Tính ổn định dung dịch pha mới rất thấp, không có những chất không hòa tan, cần phải lọc, loại bỏ kết tủa, cho chất ốn định.
– Cần định kỳ dùng HNO, để tẩy niken tách ra ở ống gia nhiệt và thành bể.
– Chi tiết sau khi hoạt hóa cần phải rửa sạch, tránh đưa vào dung dịch chất xúc tác.
– Khi không sử dụng dung dịch lâu dài, cần làm nguội dung dịch đến nhiệt độ thường, trước khi sử dụng lại cần phải lọc.
6. Những sự cố và phương pháp khắc phục mạ niken hóa học
Những sự cố và phương pháp khắc phục xem bảng 15 – 14.