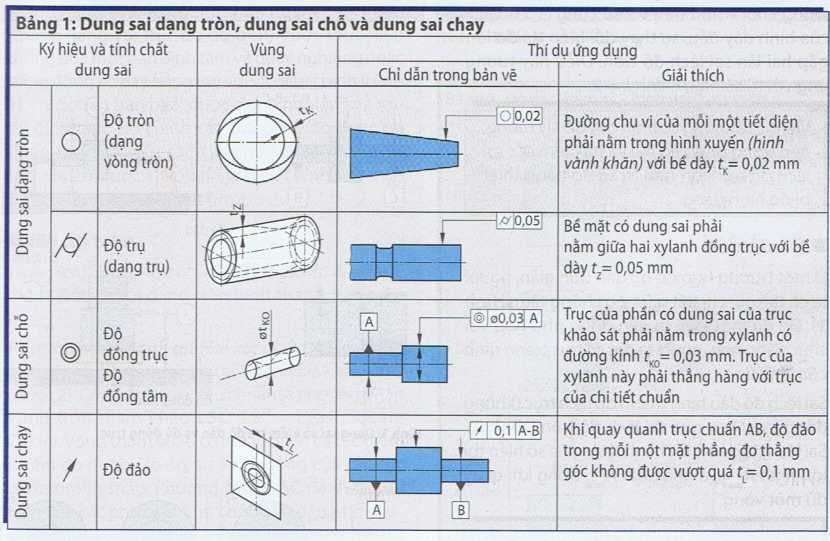
MẠ ĐỒNG HÓA HỌC
Lớp mạ đồng hóa học là đồng tinh khiết, chịu ăn mòn kém, thông thường chi dùng làm lớp mạ đồng lót. Mạ đồng hóa học dùng đế mạ lót cho phi kim loại, mạ trên mạch điện in… Thành phần dung dịch gồm có muôi chính, chất khử, chất tạo phức và chất phụ gia.
1. Mạ đồng hóa học chất khử HCHO
a. Thành phần dung dịch và chế độ làm việc mạ đồng hóa học chất khử HCHO
Dung dịch mạ đồng hóa học chất khử HCHO có tính kiềm. Để đề phòng Cu+2 sinh thành kết tủa hợp chất hyđroxit, cần phải cho vào dung dịch chất tạo phức, làm cho ion đồng ở trạng thái phức. Chất tạo phức thường dùng là KNaC4H4O6, EDTA hoặc hỗn hợp hai loại trên.
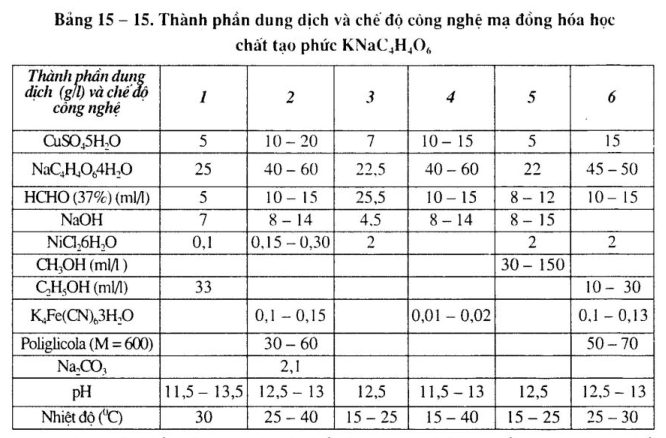
Xem bảng 15 – 15.
b. Thành phần dung dịch và chế độ công nghệ mạ đồng hóa học, chắt tạo phức EDTA
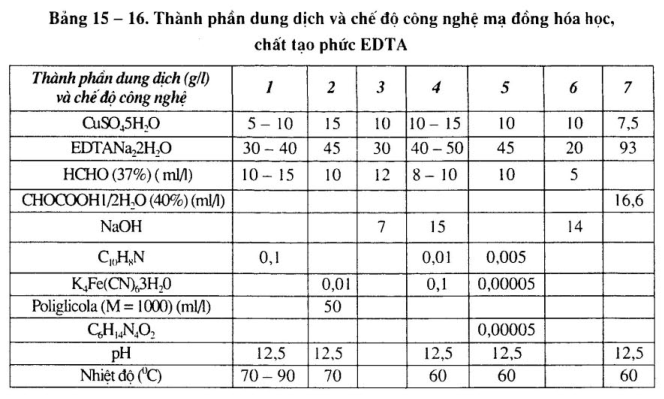
Xem bảng 15-16.
c. Thành phần dung dịch và chế độ công nghệ mạ đồng hóa học, chất tạo phức KnaC4H4O6 và EDTA.
Xem bảng 15 -17
2. Tác dụng các thành phần trong dung dịch
Muối chính, chất khử, chất tạo phức là thành phần cơ bản của dung dịch mạ đồng hóa học. Để làm ổn định dung dịch và cải thiện tính năng lớp mạ đồng, thường cho vào dung dịch các chất phụ gia.
a. CuS04
CuS04 là muối chính trong dung dịch, cung cấp ion đồng cho dung dịch mạ đồng hóa học. Đa số dung dịch mạ đồng hóa học đều sử dụng CuS04. Trong phạm vi nhất định, hàm lượng đồng trong dung dịch cao. tốc độ mạ nhanh.
b. Chất khử
Chất khử trong dung dịch mạ đồng hóa học là HCHO, NaHiPO2… Hiện nay đều dùng phổ biến dung dịch HCHO 37%. Tác dụng khử của HCHO có quan hệ với pH dung dịch. Chỉ trong điều kiện pH > 1 I mới có tác dụng khừ đồng. Nhưng pH dung dịch cao, dung dịch dễ phân hủy, làm giảm sự ổn định dung dịch. Vì vậy, đa số dung dịch mạ đổng đều khống chế pH vào khoảng 12.
c. Chất tạo phức
Chất tạo phức tác dụng với ion đồng tạo thành phức chất ổn định, chống sự hình thành kết tủa Ni(OH)2. Chất tạo phức thường dùng trong dung dịch mạ đồng hóa học KNaC4H406, EDTA, hoặc hỗn hợp KNaC4H406 và EDTA, KNaC4H4O6 còn có tác dụng là chất làm đệm.
d. NaOH
NaOH là chất điều chỉnh pH, bảo đảm pH trong phạm vi quy định.
e. Chất ổn định
Chất ổn định tránh sinh ra phản ứng phụ, nhưng đồng thời là chất xúc tác độc hại trong phản ứng mạ đồng hoá học, vì thế không nên cho nhiều. Chất ổn định thường dùng là C10H8N, K4Fe(CN)6…
3. Pha chế dung dịch
Pha chế dung dịch mạ đồng hóa học tiến hành theo trình tự nhất định. Hòa tan riêng biệt các loại hoá chất trong nước cất, cho dung dịch CuS04 vào dung dịch phức, khuấy đểu, lần lượt cho các dung dịch khác trừ dung dịch HCHO. Khi cho dung dịch HCHO, cho nước cất đến mức quy định, điều chỉnh pH trong phạm vi quy định.
4. Bảo vệ dung dịch mạ đồng hóa học
a. Cho chất tạo phức tạo phức với ion Cu+2, để đề phòng sinh ra Cu(OH)2 kết tủa. Chất tạo phức thường dùng là KNaC4H4Oh, EDTA, hoặc hỗn hợp KNaC4H406 và EDTA.
b. Cho chất ổn định với hàm lượng thích hợp, chọn chất ổn định tạo phức mạnh vói ion Cu+2 để đề phòng sinh ra Cu2O kết tủa. Cho lượng thích hợp CH2OH để kiềm chế sinh ra Cu+1.
c. Chọn công nghệ xử lý mạ đồng hoá học, đề phòng chất rắn bột đồng, ion sắt hoặc bạc lẫn vào dung dịch.
d. Với mức độ ảnh hường không lớn đến hiệu suất kết tủa, nên tận dụng giảm nhiệt độ thao tác, chú ý đề phòng quá nhiệt cục bộ.
e. Thường xuyên lọc dung dịch, bào đảm pH, diện tích bề mặt chi tiết cho vào dưới 3,8 dm2/l.
II. Mạ đồng hóa học chất khử NaH2P02
1. Thành phần dung dịch và chế độ công nghệ mạ đồng hóa học chắt khử NaH2Po2
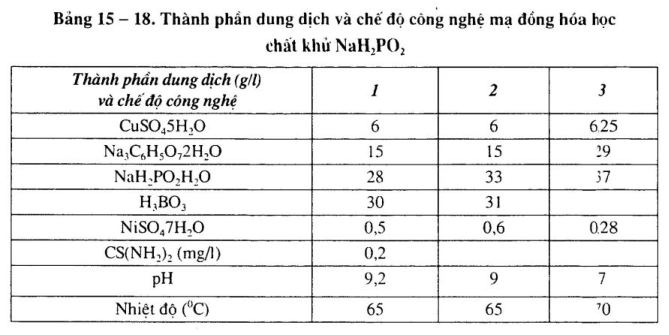
Xem bảng 15 – 18.
2. Tác dụng các thành phần trong hóa học
a. CUSO4
CuS04 là muối chính trong dung dịch, cung cấp ion đồng cho dung dịch mạ đồng hóa học. Hàm lượng muối đồng trong dung dịch tăng, hiệu suất kết tủa tăng. Tỷ lệ nồng độ ion niken với ion đồng bảo đảm 1:12.
b. NaH2P02
NaH:POi là chất khử, trong phạm vi nhất định, nếu hàm lượng NaH2P02 cao, tốc độ kết tủa cao, nhưng nếu cao quá sẽ sinh ra phán ứng phụ.
c. Na3CeHs07
Na3C6H307 là chất tạo phức với ion đồng tạo thành ion phức, có nồng độ thích hợp. Khi nồng độ Na3C6H507 cao, nồng độ ion dó ne tự do thấp, dẫn đến hiệu suất kết tủa thấp. Nếu như nồng độ Na3C6H507 thấp, dung dịch không ổn định.
d. H3B03
HỊBO3 ảnh hường lớn tới tốc độ kết tủa lớp mạ. Khi dung dịch không có H3BO3 tốc độ kết tủa rất chậm. Nồng độ H3BO3 lớn hơn 0,5 mol/1, tốc độ kết tủa không tăng lên.
e. CS(NH2)2
CS(NH2)2 là chất ổn định với hàm lượng nhỏ. dung dịch ổn định, đồng thời có tốc độ kết tủa tốt.
f. NiS04
Bề mặt kim loại nền được xúc tác. mạ đổng hoá học tiến hành thuận lợi. Sau khi toàn bộ kim loại nền được phú lớp đồng, đối với phản ứng oxi hoá của NaH3PO2. đồng không có tác dụng xúc tác, do đó mạ đồng không thực hiện được. Khi cho vào dung dịch một ít muối niken, ion niken được khử thành kim loại niken, có tác dụng xúc tác rất mạnh với phản ứng ỏxi hóa NaH2P02, làm cho phán ứng kết tủa được thực hiện.
3. Phương pháp làm ổn định mạ đồng hóa học
a. Cho lượng thích hợp CH3OH để kiềm chế sinh thành ion Cu+1;
b. Sử dụng nồng độ thấp, để kiềm chế phản ứng ôxi hóa Cu+2, hoặc trong dung dịch cho polivinylalcohol để sinh thành bột đồng, mất đi tác dụng xúc tác;
c. Cho chất tạo phức với đồng, để kiềm chế ion Cu+1;
d. Khống chế tốt các điều kiện công nghệ.
4. Bảo vệ dung dịch mạ đồng hóa học
a. Định kỳ hoặc liên tục lọc dung dịch, kịp thời loại bỏ bột đóng và các tạp chất khác trong dung dịch, bảo đàm dung dịch sạch;
b. Khi không sử dụng dung dịch, dùng dung dịch H2SO4 loãng điều chỉnh pH = 9 – 10. Trước khi sử dụng, dùng NaOH loãng điều chỉnh pH trong phạm vi quy định;
c. Bổ sung hóa chất phải pha thành dung dịch loãng, vừa khuấy, vừa cho vào;
d. Không đê dung dịch quá nhiệt cục bộ;
e. Dùng chất oxi hóa để kéo dài thời gian sử dụng dung dịch.
5. Sự cố thường xảy ra và phương pháp khắc phục
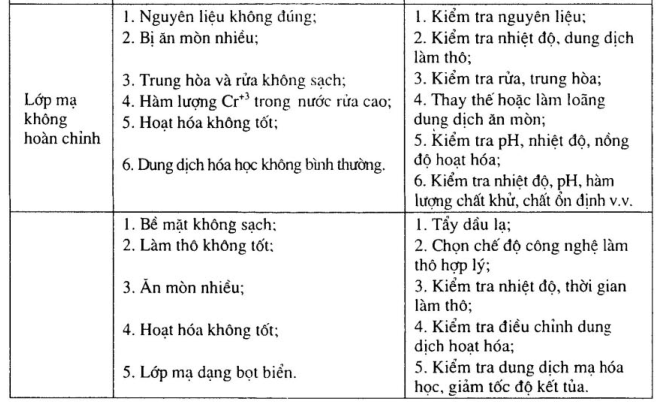
Sự cố thường xảy ra và phương pháp khắc phục mạ đồng hóa học xem bảng 15- 19.